 대한내분비학회 지난 호 웹진 보기
대한내분비학회 지난 호 웹진 보기
Webzine No.44 | 제18권 2호 <통권68호>
2025년 여름호 대한내분비학회 웹진Webzine No.44 | 제18권 2호 <통권68호>
2025년 여름호 대한내분비학회 웹진
임승순 계명대학교 의과대학 생리학교실
비알코올성 지방간질환(NAFLD)의 명칭이 최근 MASLD(Metabolic dysfunction-Associated Steatotic Liver Disease)로 개정됨에 따라, 단순한 간 내 지방 축적을 넘어 전신 대사 장애와의 연관성을 강조한 연구가 급증하고 있다. MASLD는 인슐린 저항성, 비만, 제2형 당뇨병과 밀접한 관련이 있으며, 심혈관질환과도 높은 상관관계를 가진다. 특히, MASLD가 간섬유화 및 간세포암(HCC)으로 진행되는 비율이 높다는 점에서 조기 진단과 병태생리학적 기전 이해가 중요한 이슈로 부각되고 있다.
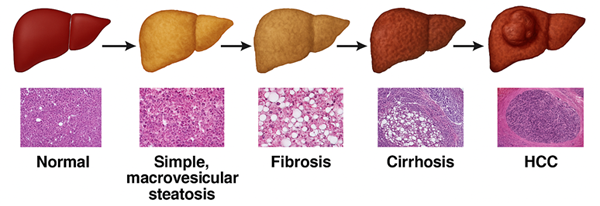
간은 중심적인 대사 기관으로서, 포도당, 아미노산, 지방산 대사뿐 아니라 독성물질 해독 및 담즙산 합성, 면역 조절 기능을 포함한다. 이러한 대사적 복합성과 전신 항상성 유지 역할 때문에, MASLD와 같은 간질환은 단순한 장기 이상이 아닌 전신 대사 질환으로 접근해야 한다는 인식이 확산되고 있다. 이에 따라, 간세포 대사 리프로그래밍, 면역세포와의 상호작용, 미토콘드리아 기능 변화에 주목한 최신 연구 전략들이 제시되고 있으며, 이들 분자 기전을 기반으로 한 신규 치료 표적 발굴이 활발히 진행 중이다.
(2) 간세포 대사 기능 조절을 기반으로 한 치료 타겟 탐색 연구최근 연구들은 간세포 내 지방산 산화(FAO), 산화적 인산화(OXPHOS), TCA 회로 대사의 변화가 MASLD 병태에 직접적으로 연관됨을 제시하고 있으며, 특히 미토콘드리아 기능 저하가 대사성 간질환의 주요 병인 기전으로 부각되고 있다. PPARα, SIRT1, AMPK 등의 전통적 대사 조절 인자 외에도, 최근에는 TFEB, ATF4, CHOP 같은 스트레스 반응 인자들과 염증성 사이토카인들의 조절이 간 내 대사 흐름 및 섬유화 진행과 밀접한 연관을 보인다는 점이 밝혀졌다. 따라서 간세포 대사 기능을 분자적 수준에서 정량적으로 분석하고, 이를 기반으로 전임상 및 임상 단계에서 표적화 가능한 조절 기전을 제시하는 연구들이 핵심 전략으로 떠오르고 있다.
고전적인 간 대사 연구는 간추출물 기반의 단일 효소 활성 측정이나 대사물 농도 측정에 의존해 왔다. 그러나 이러한 정적 방법은 세포 내에서 실제로 어떤 대사 흐름이 일어나는지를 반영하기 어렵다. 이에 따라, 최근에는 안정 동위원소 추적(Stable Isotope Tracing)과 질량 분석 기반 대사체학(Metabolomics)을 결합한 in vivo metabolic flux analysis가 대사 연구의 중심으로 부상하였다. 특히 13C-Glucose, 13C-Palmitate, 15N-Glutamine 등의 동위원소 표지 기질을 사용하여 간에서의 포도당 신생합성(gluconeogenesis), 지방산 산화, 아미노산 회전 등을 정량적으로 평가할 수 있다. 예를 들어, [U-13C]glucose 투여 후 간조직 내 M+3 lactate의 생성률을 통해 해당과정(glycolysis) 활성 정도를 유추할 수 있으며, [U-13C]palmitate를 활용하면 β-oxidation 및 TCA 회로의 활성 흐름을 추적할 수 있다. 최근 연구들은 이 기법을 활용하여, MASLD 모델에서 대사 흐름이 어떻게 재편되는지를 정량화하고 있으며, 특히 미토콘드리아 기반 대사 기능 저하와 그것이 야기하는 염증, 스트레스 반응의 연결 고리를 규명하는 데 큰 기여를 하고 있다.
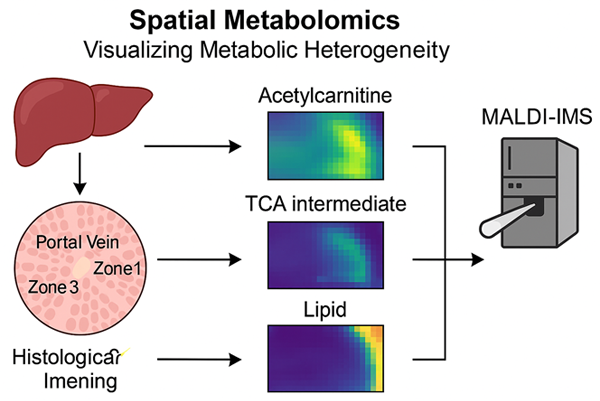
간 조직은 해부학적으로 다양한 소엽 구조를 가지며, portal vein에서 hepatic vein으로 향하는 zonation 특성을 보인다. 이에 따라 간세포의 대사 기능도 중심부(zone 3)와 주변부(zone 1)에 따라 이질성을 나타낸다. 전통적인 bulk metabolomics로는 이러한 지역적 차이를 분석하는 데 한계가 있다. 이를 극복하기 위해 등장한 공간 대사체학(spatial metabolomics)은 조직 절편 내에서 대사물질 분포를 이미지화하여 간 내부의 대사적 이질성을 시각화할 수 있다. 최근에는 MALDI-IMS (Matrix-Assisted Laser Desorption/Ionization Imaging Mass Spectrometry)를 활용하여 간 조직 내 아세틸카르니틴, TCA 중간물질, 지질 대사물질들의 분포를 분석하고 있으며, MASLD 모델에서 특정 대사물질의 축적이 섬유화 영역과 일치함을 보여주는 연구들이 보고되고 있다. 이 기술은 특정 병리적 변화가 동반된 부위에서 대사적 이상이 먼저 발생하는지, 혹은 대사 재편성이 병리적 진행의 결과인지에 대한 인과관계를 설정하는 데 큰 도움을 준다.

간은 문맥(portal vein)을 통해 혈액을 공급받고, 간정맥(hepatic vein)을 통해 혈액을 배출하는 구조적 특성을 가진다. 이러한 해부학적 이점을 활용하여, 간에서 흡수하거나 분비하는 대사체를 직접적으로 비교 분석할 수 있는 동정맥 샘플링 기반 대사체학(AV metabolomics) 기법이 주목받고 있다. 대표 연구로는 간문맥과 간정맥에서 채취한 혈액을 LC-MS/MS 기반으로 분석하여, 포도당, 젖산, 지방산, BCAA, 담즙산 등의 교환 양상을 정량화하고, MASLD 진행 단계에 따라 간에서의 영양소 소비 및 분비 기능의 변화 양상을 규명한 사례가 있다. 특히 이 기법은 간 외 조직과의 대사적 네트워크 분석이 가능하다는 점에서 중요하며, 최근에는 간-장 상호작용, 간-골격근 대사 연계 연구에도 응용되고 있다.
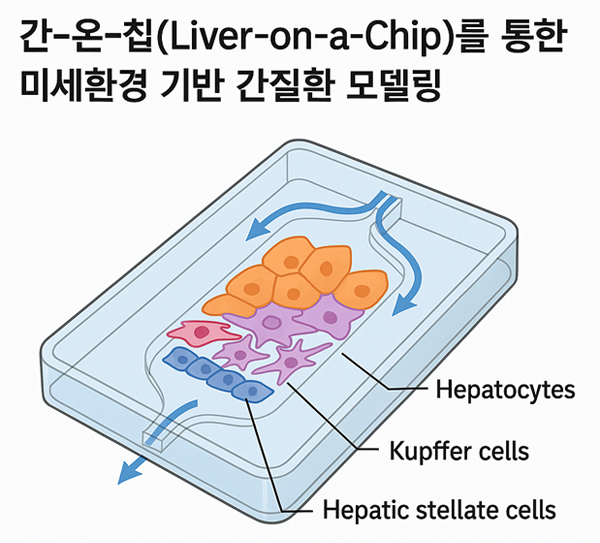
(4) 간-온-칩(Liver-on-a-Chip)을 통한 미세환경 기반 간질환 모델링간은 다양한 세포 유형(간세포, 쿠퍼세포, 간성상세포 등)과 복잡한 혈류 환경을 갖는 장기로, 이러한 미세환경이 대사 기능 및 질환 발생에 중요한 역할을 한다. 전통적인 2D 세포 배양이나 동물모델은 이러한 인간 간의 미세환경을 충분히 반영하지 못하며, 약물 반응성과 병리적 변화의 재현에 한계가 있다. 이러한 문제를 극복하기 위해 개발된 간-온-칩(Liver-on-a-Chip) 기술은 마이크로플루이딕 기반의 3차원 조직 공학 플랫폼으로, 실제 간조직의 구조적⦁기능적 특성을 모사할 수 있다. 특히, 이 기술은 간세포와 비간세포(예: 내피세포, 면역세포 등)를 공배양하면서 지속적인 유동성(fluid shear stress)을 제공함으로써, 간 혈류에 따른 대사 활성의 zonation을 재현할 수 있다. 최근 연구에서는 이 기술을 이용해 MASH 또는 약물 유도 간독성 모델을 재현한 사례들이 증가하고 있으며, 예를 들어 특정 지질 대사 장애가 내피세포 손상 및 섬유화 반응으로 이어지는 기전을 칩에서 관찰하기도 하였다. 또한, 환자 유래 유도만능줄기세포(iPSC)에서 분화된 간세포를 간-온-칩에 적용함으로써, 환자 특이적인 간 대사 반응을 평가하고 개인 맞춤형 치료법을 시험하는 플랫폼으로도 활용되고 있다. 이 기술은 생체 내 간질환의 동역학적 과정을 보다 정밀하게 분석하고, 인체 유사성(human relevance)을 갖춘 예측 플랫폼으로서 전임상 연구 및 신약개발에 중요한 도구로 자리 잡고 있다.
간은 전신 대사 조절의 중심 기관으로, MASLD와 같은 대사성 간질환의 병태 생리를 이해하기 위해서는 정적 대사체 수준을 넘은 대사 흐름 분석과 공간적 대사 이질성 분석, 그리고 혈류 기반 대사 교환 분석이 필수적이다. 안정 동위원소 추적, 공간 대사체학, 동정맥 대사체 분석, 간-온-칩과 같은 최신 기법들은 간세포 수준의 미세한 대사 조절 이상부터 전신 대사 불균형까지의 연결 고리를 밝히는 데 중요한 도구로 자리잡고 있다. 이러한 기술을 바탕으로 새로운 진단 바이오마커와 분자적 치료 타겟이 발굴되어, MASLD의 근본적 치료 전략으로 이어지기를 기대한다.