



암의 골전이 (Cancer Bone Metastasis)를 정복하기 위한 연구
박석인(고려대학교 의과대학 생화학·분자생물학교실)
뼈는 골다공증, 류마티즘, 골관절염 등의 질병 뿐 아니라, 암 전이의 호발 장기라는 점에서 중요하다. 실제로 뼈는 폐, 간에 이어 암 전이가 흔히 일어나는 3대 장기 중에 하나이며, 특히 고형암 중에 유방암과 전립선암의 최호발 전이 장기이다. 그 외 다발성 골수종(multiple myeloma), 폐암, 갑상선암과 신장암 등이 뼈를 흔히 침범하는 암들이다. 미국과 유럽의 데이타에 의하면 전립선암 원격전이의 90%, 유방암 원격전이의 48%정도를 골전이가 차지한다. 게다가 전립선암 원격전이의 88%, 즉 거의 대부분의 전립선암 전이는 오직 뼈에만 나타나며 다른 장기로 전이가 되는 경우는 드물다. 전립선암과 유방암은 남녀의 대표적 내분비 기관에서 생기는 암종으로, 초기 진행과정에서 홀몬 의존적이라는 공통점이 있다.
내분비 연관 암종 (endocrine-related cancers) 두 가지가 공통적으로 골전이를 일으킨다는 점이 무척 흥미롭다. 골전이는 높은 이환율 뿐 아니라 환자 생존률 측면에서도 임상적 중요성이 있다. 전이가 없거나 국소 전이만 있는 1~3기 유방, 전립선암의 5년 상대 생존률이 90%를 넘는 반면, 일단 원격전이가 일어나면 생존률이 30%대로 급격히 감소한다. 골전이는 암 진행 과정의 말기 증상으로 나타나는데, 척추, 골반, 넓적다리뼈 등 체축 골격계를 주로 침범한다. 골전이 암세포가 성장함에 따라 뼈가 파괴되며 (골용해, osteolysis), 이에 따라 병리학적 골절, 척수 압박이 일어나고, 결과적으로 극심한 통증과 거동 불능에 따라 환자 상태가 급격히 나빠지며 사망에 이른다.
위에 서술한대로 높은 이환율, 사망률, 심각한 합병증 등에도 불구하고, 골전이에 대한 효과적인 치료 방법은 현재 없다. 암세포를 겨냥하여 항암 화학요법, 방사선 치료 등을 시행하거나, 드물게 수술적 제거를 하지만, 어떤 방법도 골전이를 완치하지 못한다. 그런데, 골전이암의 치료를 위해 암세포 뿐 아니라 암 기질세포를 억제하는 전략이 널리 사용되는데, 이 때 대표적인 표적세포는 파골세포(osteoclast)이다. 파골세포 억제제는 골다공증 치료제로 널리 사용되는 약물인데, Dr. Greg Mundy의 “골전이의 악순환 이론”에 따라 골전이암의 치료에 응용되었다. 즉, 뼈에 전이된 암세포는 주변 기질세포(stromal cells)를 변화시키기 위하여 여러 인자들을 분비하는데, 대표적인 인자는 부갑상호르몬 연관인자(parathyroid hormone-related peptide, PTHrP)이다. 이때 분비된 PTHrP는 조골세포를 자극하여 세포분열을 촉진하고, 조골세포의 사이토카인 발현을 촉진하는데, 대표적으로 Monocyte Colony Stimulating Factor (M-CSF)와 Receptor Activator of NF Kappa B Ligand (RANKL) 등이 발현된다. M-CSF와 RANKL은 파골세포의 분화, 형성을 촉진하는데, 이렇게 만들어진 파골세포가 암세포 주위의 뼈 조직을 파괴하고, 뼈 매트릭스에 저장되어 있던 여러 성장인자들 (대표적으로 transforming growth factor , TGF-)이 방출되어 암세포 성장을 촉진하게 된다. 즉, ‘암세포 조골세포 파골세포 골파괴 성장인자 암세포 성장’의 순환고리가 만들어지는데, 이 순환 고리를 끊기 위해 파골세포 억제제로 비스포스포네이트 약물이나 데노수맙 (RANKL 중화 항체)을 사용한다. 파골세포 억제제는 공통적으로 골전이의 증상을 개선시켜주는데, 골용해와 통증을 줄여준다. 하지만, 골다공증 치료보다 높은 용량으로 사용하는 파골세포 억제제는 특징적 부작용들 뿐 아니라, 골전이 진행을 멈추지 못하고 환자의 생존 (Overall Survival)도 증가시켜주지 못하는 것으로 알려져 있다. 최근 본 연구자들을 비롯한 많은 연구자들이 골전이 미세환경 속에서 암세포-조골세포-파골세포의 삼각 상호작용을 넘어선 보다 복잡한 세포 상호작용에 관심을 두고 연구하고 있다.
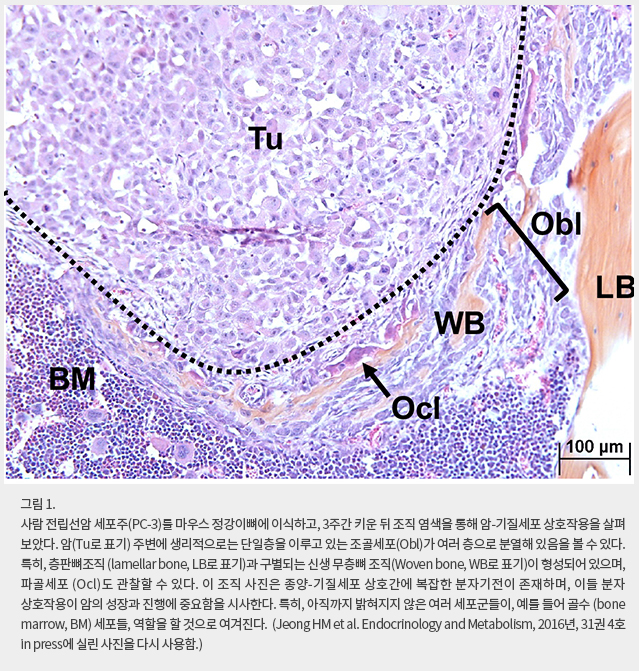
현재 종양학 연구와 치료의 최신 개념은 종양미세환경에 집중되어 있다. 즉, 암은 무한히 분열, 증식하는 암세포의 집합체가 아니라, 암세포와 주변 기질세포들의 총합이라는 것이 종양 미세환경 (tumor microenvironment) 개념이다. 암 기질세포는 단순히 암 덩어리에 섞여 존재하는 것을 넘어서, 암의 성장과 진행에 필수적이며 또 각각의 세포군이 독특한 역할을 수행한다. 대표적인 종양 기질세포인 혈관내피세포는 암의 성장, 진행에 필수불가결하며, 다른 세포군이 혈관내피세포의 기능을 대체할 수 없다. 이 외에도, 종양 연관 섬유모세포 (tumor-associated fibroblasts), 세포외기질, 종양 내 산소분압, 산성도, 기질 경직도 (matrix rigidity) 등이 종양 미세환경을 구성하는 요소들로 꼽힌다. 보다 더 최신 연구는 종양 미세환경내 염증, 면역세포들의 역할에 주목하고 있다. 근대 병리학의 아버지로 불리는 Rudolph Virchow는 이미 1858년에 ‘암은 낫지 않는 상처 (Wound that never heals)’라고 정의하였는데, 이를 현대에 와서 돌이켜보면 종양미세환경내 염증 세포, 면역 반응, 면역세포의 중요성에 대한 선구적 견해였다. 실제로, 현재 종양학 임상과 기초는 면역치료의 시대라고 불러도 좋을 만큼 종양 vs. 면역체계 상호작용에 집중되어 있다.
이와 같은 맥락에서 본다면 암의 골전이는 다른 전이 과정과 다른 독특한 점이 있다. 즉, 골전이는 암세포가 1차 면역기관인 골수(bone marrow)로 찾아 들어와, 골수와 뼈를 지배하는 과정을 거친다는 점이다. 일반적인 암 조직들은 염증, 면역세포가 침윤되어 들어오는데 반해, 골전이 암세포는 면역기관으로 침윤해서 들어간다. 그래서, 골전이 과정은 다른 종류의 암 전이 과정과는 면역학적 측면에서 구별된다. 본 연구자는 텍사스대학교 엠디앤더슨 암센터에서 박사과정 시절부터 암의 골전이에 집중해서 연구해오고 있는데, 최근에는 전이성 전립선암이 골수유래 면역억제세포(Myeloid-Derived Suppressor Cells, MDSC)를 촉진하여 골전이 과정에 기여한다는 연구결과를 발표하였다. MDSC는 PD-1/PD-1L 축과 함께 최근들어 항종양 T세포 공격을 회피하는 암세포의 주요 방어기전으로 이해되고 있는데, 암세포는 여러 조절 기전을 통해 이들 면역억제 기전을 촉진하는 것으로 여겨진다. 본 연구자는 2012년 실험실을 독립한 이후로 계속하여 어떻게 골전이성 암세포가 골수 내 MDSC를 이용하여 골전이성 미세환경을 친종양 (pro-tumorigenic) 환경으로 바꾸는지에 집중하여 연구를 진행하고 있다. ‘골전이암의 면역학적 측면’이라는 점과, 그간 암세포-조골세포-파골세포로 이어지는 악순환 이론을 확장하여 골수내 세포군을 넣어 골전이의 맥락을 이해하려는 노력이라는 점에서 연구의 참신성을 찾을 수 있다.
Weilbaecher, K. N., Guise, T. A., & McCauley, L. K. (2011). Cancer to bone: a fatal attraction. Nature Reviews Cancer, 11(6), 411–425. http://doi.org/10.1038/nrc3055
Talmadge, J. E., & Gabrilovich, D. I. (2013). History of myeloid-derived suppressor cells. Nature Reviews Cancer, 13(10), 739–752. http://doi.org/10.1038/nrc3581
Park, S. I., Lee, C., Sadler, W. D., Koh, A. J., Jones, J., Seo, J. W., et al. (2013). Parathyroid hormone-related protein drives a CD11b+Gr1+ cell-mediated positive feedback loop to support prostate cancer growth. Cancer Research, 73(22), 6574–6583. http://doi.org/10.1158/0008-5472.CAN-12-4692
Park, S. I., Liao, J., Berry, J. E., Li, X., Koh, A. J., Michalski, M. E., et al. (2012). Cyclophosphamide creates a receptive microenvironment for prostate cancer skeletal metastasis. Cancer Research, 72(10), 2522–2532. http://doi.org/10.1158/0008-5472.CAN-11-2928
Park, S. I., Soki, F. N., & McCauley, L. K. (2011). Roles of bone marrow cells in skeletal metastases: no longer bystanders. Cancer Microenvironment, 4(3), 237–246. http://doi.org/10.1007/s12307-011-0081-8

Copyright(c) Korean Endocrine Society. All rights reserved.