


줄기세포를 사용한 연구 및 치료
권오빈 (서울의대 생화학교실)
최근 일본에서 줄기세포(stem cell)를 사용한 치료에 박차를 가하고 있다는 소식들을 자주 접하게 된다. 2018년 11월, 교토대에서는 파킨슨병 환자의 뇌에 유도만능줄기세포(induced pluripotent stem cell, 이하 iPSC)로부터 분화된 신경전구세포(neural precursor)를 이식했다고 발표했으며, iPSC로부터 분화시킨 혈소판의 효능 및 안전성을 재생불량성빈혈 환자에게서 검증하는 임상시험도 허가받은 상태이다. 환자들은 6개월간 총 3번에 걸쳐 iPSC 유래 혈소판을 주입받은 뒤, 1년간 치료법의 효능과 안전성을 검증받는다. 게이오대는 iPSC로부터 신경줄기세포(neural stem cell)를 만들고 중증 척수손상 환자에 이식하는 임상연구를 돌아오는 여름 경에 실시할 전망이다. 필자가 박사후과정으로 연구하던 미국 하버드대학교 내에서도 이러한 줄기세포를 이용한 치료를 임상시험으로 진행하고자 하는 흐름이 있었다. 많이 드러나지는 않았지만 외신을 통해 들려오는 소식에는 난치병 환자들이 줄기세포 치료를 위해 중국으로 향하고 있다는 기사도 있다. 본 연구자의 경우에도 좋은 기회를 얻어 최근까지 미국 하버드대학교 Psychiatry 부속병원인 McLean Hospital 에서 줄기세포의 분화를 조절하는 당대사(glucose metabolism) 연구를 진행하는 동안 이러한 치료가 가시권에 들어와 있음을 실감하였으며, 이에 줄기세포를 사용한 연구 및 치료의 동향을 글로써 정리해보고자 한다.
줄기세포(stem cell)란 무엇인가? 국어사전에는 “배아 또는 성체에 있는, 여러 종류의 세포로 분화할 수 있는 미분화 세포” 라고 정의되어 있는데, 이 지면에서는 “스스로 복제하고, 여러 종류의 세포로 분화할 수 있는 능력[줄기세포능, stemness]을 가진 세포”로 지칭하겠다. 굳이 “배아 또는 성체에 있는” 이라는 단어를 빼는 이유는 지면에서 다룰 iPSC(induced pluripotent stem cell)의 경우 배아 또는 성체에 존재하는 것이 아닌, 체세포를 인체 외부에서 인공적으로 만들어낸 것이기 때문이다. 배아줄기세포(embryonic stem cell)의 경우 말 그대로 아직 줄기세포능이 남아있는 배아의 미분화된 속세포덩이(inner cell mass)에서 유래된 줄기세포이다.
야마나카 신야 교수(교토대)가 iPSC를 최초로 개발한 공로로 2012년 노벨 생리의학상 수상자로 선정되기 이전에도 줄기세포는 연구되고 있었다. iPSC가 개발된 이후로 달라진 점이 있다면 배아를 사용하지 않고 체세포로부터 만들어내므로 윤리적 장벽을 넘을 수 있다는 점, 각 환자의 유전자를 그대로 지니고 있으므로 환자 개개인의 병태생리를 파악할 수 있다는 점 등이 있다. 체세포로부터 iPSC를 만드는 과정을 역분화(reprogramming)라고 하는데 기본적으로는 야마나카 인자로 불리는 Oct3/4, Sox2, c-myc 및 Klf4를 세포에 도입시키는 것을 바탕으로 한다. 이를 좀더 단시간에 정밀하게 유도하고, 균일하고 높은 수율로 줄기세포를 만들기 위한 연구들이 활발히 진행되고 있다. 제작된 줄기세포는 3가지 배엽으로의 분화 및 기형종(teratoma)으로의 분화를 유도시켜 분화능력을 확인한다. 이렇게 채취되거나 만들어진 줄기세포는 실험자의 입장에서는 매우 세심한 관리가 필요한데, 일반적인 세포주(cell line)와 비교하여 보았을 때는 줄기세포능을 잃지 않도록 적절한 계대배양(subculture) 시점과 계대배양횟수(passage number)의 제한을 엄격히 지켜주어야 하며, 세포들이 단일 세포(single cell)로 분리되어 자라지 않도록 유의하고, 줄기세포능 유지에 특화된 배지(예를 들어 mTeSR™, E8™ 등)를 사용하여야 한다. 만일 사람에게 이식하고자 하는 원료로서의 줄기세포를 제작하는 경우 Good manufacturing practices (GMP) 기준에 적합한 재료만을 사용해야 한다.
줄기세포를 사용하여 원하는 특정 체세포로 분화시키는 방법은 체세포 종류에 따라 (예를 들어 신경세포, 췌장세포, 혈액세포 등) 매우 다양하여 본 지면에 자세한 설명은 생략한다. 요약하면 많은 분화 방법들이 실제 인간 배아로부터 특정 체세포로 분화하는 과정을 모방하여, 단계별로 중요한 인자, 특히 전사인자(transcription factor)의 발현을 세밀하게 조절하는 방식으로 진행된다. 짧게는 수주에서 길게는 수개월이 걸리는 작업에 해당하며, 프로토콜에 따라서는 매일마다 배지의 종류를 바꾸어가며 조절해주어야 하는 작업이 될 수 있다. 특정 체세포로 분화가 되는 과정에 있어서 단계별로 발현하는 표지자(marker)를 확인하는데, 예를 들어 파킨슨병 치료에 사용되는 도파민신경세포(dopaminergic neuron)의 경우 신경전구세포 단계에서 주요 전사인자인 Nurr1, Fox2A 의 발현을 확인하고, 신경의 성숙 단계에서 도파민 합성 효소인 tyrosine hydroxylase를 확인한다. 또한 세포가 성숙하여 특정 체세포의 특징 및 기능을 가지는지를 다양한 방법으로 확인하는데, 예를 들어 신경의 경우 해당 신경에 특이적인 전기생리학적 특징들을 확인한다.
환자로부터 유래된 유도만능줄기세포의 경우, 치료적 목적 이전에 일단 각 환자가 가진 질환과 연관된 체세포 종류로 분화시켜 (조직 생검 대신) 해당 환자의 병태생리를 파악하는 질병 모델로 사용하고, 각 환자별로 적합한 약제 스크리닝(drug screening)에 응용할 수 있다 (그림 1). 향후 기술이 좀더 발전하는 경우 돌연변이가 있는 환자에게서는 유전자가위를 사용한 유전자교정의 가능성이 열려 있으며, 이렇게 교정된 세포의 경우 안정성이 확보되면 이식을 통해 손상된 조직을 대체하는 치료를 염두에 둘 수 있다.
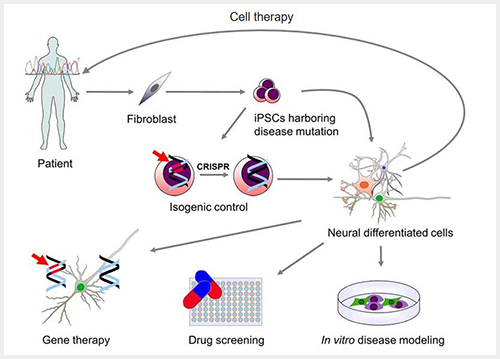
서두에서 나온 질환들이 줄기세포 치료를 고려하게 되는 이유는 무엇인가? 재생불량성빈혈 환자의 줄기세포치료 피시험자는 주로 수혈 후 거부반응(rejection)이 심한 환자들로서, 지혈에 필수적인 혈소판이 부족해도 이와 같이 수혈 자체가 어려운 경우 환자 본인으로부터 유래한 혈소판이 대안이 될 수 있다. 파킨슨병은 퇴행성신경질환 중 두 번째로 호발하는 질환으로, 노화 등으로 인해 점진적으로 중뇌(midbrain)에서 도파민신경세포가 손상되어 손떨림, 보행장애 등의 운동장애가 일어나 일상에 큰 지장을 받는데, 인간 수명이 늘어남에 따라 현재까지 개발된 약제들의 조합으로도 증상이 악화되는 환자가 늘어나고 있어서 새로운 치료법이 요구된다. 사고 등으로 인한 척수손상환자의 경우 손상된 척수 이하 부위가 관장하는 사지 및 배설 기관 등의 기능이 마비되지만, 현재까지 손상된 부위를 원상복귀시키는 치료법은 없다. 이러한 신경질환들에 대해서는 손상된 신경들을 줄기세포에서 분화시킨 신경으로 대체해주어 기능을 회복시킨다는 것이 치료의 개념이다.
줄기세포 치료의 경우 환자 본인으로부터 유래된 iPSC를 분화시킨 세포 외에도, 체세포로부터 다른 체세포로 직접적인 변환을 하는 방법(direct conversion)이 개발되고 있다. 이렇게 본인의 세포를 이식(autologous graft) 받는 것 뿐만 아니라 타인으로부터 유래된 세포를 이식(allogeneic graft) 받는 것도 가능한데 이 경우 이식거부반응을 막기 위한 조치가 필요하며, 배아줄기세포의 경우 윤리적인 문제를 고려해야 한다 (그림 2).
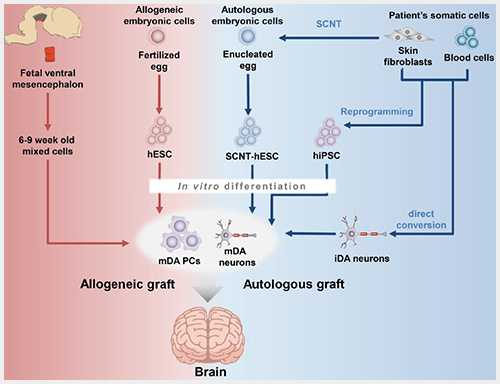
이러한 줄기세포로부터 유래된 세포를 이식하는 치료를 진행하기 위해 넘어야 하는 장벽은 무엇인가? 첫째, 안정성 측면, 특히 종양발생가능성과 독성의 문제이다. iPSC의 특성 상 증식할 수 있는 가능성을 내포하고 있으며, 특정 세포로의 분화를 유도하였다고 해도 원하지 않는 세포로 분화할 수 있는 능력이 남아있을 가능성이 있다. 둘째, 기능적 측면이다. 각 질환의 병태생리에 근거하여 소멸되었거나 기능을 하지 못하는 세포를 대체하고자 외부에서 분화시킨 세포를 해당 부위에 이식하였을 때 실제로 기존 건강한 세포가 수행하였을 기능을 재현할 수 있어야 한다. 위 두 가지 문제를 극복하기 위해서 줄기세포 연구자들은 특정 세포로 분화됨에 따라 증식에 관련된 신호가 현저히 줄어드는지 확인하고, 질환동물모델을 이용한 전임상실험에서 장기적으로 종양이 생기지 않고 독성이 없음을 보여주어야 하며, 또한 해당 질환동물모델에서 보이는 증상을 개선함을 보여주어야 한다. 셋째는 면역억제의 필요성이다. 이는 배아줄기세포를 사용하는 치료에서의 문제로써, 타인의 세포에 대한 이식거부반응을 막기 위한 면역억제제 사용은 필수적이며, 이에 따른 부작용을 고려해야 한다. 이를 극복하기 위해 장기별 면역반응을 일으키는 인자들(예: MHC class 등)이 서로 다른 배아줄기세포들을 저장한 은행을 관리함으로써 각 환자별로 최소한의 면역반응을 가질 세포를 골라서 이식할 수 있도록 하는 경우가 있다. 넷째는 현실적인 문제로, 줄기세포치료의 품질관리(quality control)의 측면이다. 인간배아줄기세포의 경우 동일한 이름을 가진 줄기세포라고 하여도 기관마다, 연구실마다 배포되어 보관, 유지되는 중에 줄기세포의 특성이 달라졌을 가능성이 고려되어야 한다. 특히 이러한 품질관리는 iPSC를 이용한 치료를 계획할 때 더욱 문제가 될 수 있는데, 각 환자의 체세포로부터 유래된 iPSC마다 동일한 줄기세포능을 가지도록 역분화 방법을 정립하는 데에 많은 노력과 재원, 시간이 필요하다. 또한 환자별 iPSC마다 이식 후 종양발생가능성과 독성의 문제, 기능의 문제를 전임상실험을 통해 확인하고 이식을 해야 하는가에 대한 문제 등도 존재한다. 마지막으로 윤리적 측면이다. 일차적으로 인간배아줄기세포를 얻는 과정은 많은 윤리적인 쟁점이 항상 존재해 왔으니 설명을 생략하도록 하겠다. 환자별 iPSC의 경우에는 이런 윤리적 문제를 피해갈 수 있는 좋은 방법이 되겠으나, 위의 품질관리측면에 대단히 많은 재정이 필요하고 인력이 필요한 데 비해 얻어지는 결과가 미비한 경우 자원배분 측면에서의 문제가 될 여지는 남아있다.
임상시험으로서 iPSC세포를 처음 사람에게 이식한 것은 2013년이 시작점이었는데, 일본에서 iPSC로부터 분화시킨 색소상피세포를 노인성 황반변성증을 앓는 70대 여성 환자에 이식한 사례였다. 2014년부터 임상시험이 진행되었으나, 이후 암 유발 가능성을 보이는 돌연변이가 발견되면서 2015년 시험이 중단되었다. 이를 계기로 활발한 연구를 통해 기술이 개선되고 안전성에 대한 실험적인 근거가 확보되면서 줄기세포연구가 활기를 되찾는 추세로 보인다. 국내에서도 줄기세포 연구에 대한 투자가 다시 활기를 띠고 있는데, 그 일례로 과학기술정보통신부에서 공지한 2019년도 1차 바이오‧의료기술개발사업 신규과제는 줄기세포/조직재생 분야로써, (1) 오가노이드 기반 질환모델링 및 신약 평가 기술 개발 및 (2) 줄기세포 응용 융복합 세포전환기술 개발을 추진하고 있다. 앞서 정리한 것처럼 줄기세포를 사람 치료에 적용하는 데에는 많은 난관들이 있지만, 그만큼 더욱 연구가 많이 필요한 분야이다. 본지에서는 연구자가 직접 참여한 연구를 토대로 설명하였으나, 내분비내과 영역에서의 질환 중에서는 당뇨병 치료를 위해 줄기세포로부터 이자섬(pancreatic islet)을 만들거나, 베타세포만으로 분화시키는 등의 프로토콜이 활발히 개발되고 있다. 그 밖에 몸에서 손상된 세포를 복구시키는 의미로서의 줄기세포치료에 대해 내분비학과 관련된 많은 연구자들이 관심을 가지고, 내분비대사질환들의 연구와 치료에 있어서 줄기세포의 유용성을 고찰해보는 기회가 되었으면 한다.
Barral, S. and M. A. Kurian (2016). "Utility of Induced Pluripotent Stem Cells for the Study and Treatment of Genetic Diseases: Focus on Childhood Neurological Disorders." Front Mol Neurosci 9: 78.
D'Amour, K. A., A. G. Bang, S. Eliazer, O. G. Kelly, A. D. Agulnick, N. G. Smart, M. A. Moorman, E. Kroon, M. K. Carpenter and E. E. Baetge (2006). "Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells." Nat Biotechnol 24(11): 1392-1401.
Kroon, E., L. A. Martinson, K. Kadoya, A. G. Bang, O. G. Kelly, S. Eliazer, H. Young, M. Richardson, N. G. Smart, J. Cunningham, A. D. Agulnick, K. A. D'Amour, M. K. Carpenter and E. E. Baetge (2008). "Pancreatic endoderm derived from human embryonic stem cells generates glucose-responsive insulin-secreting cells in vivo." Nat Biotechnol 26(4): 443-452.
Sonntag, K. C., B. Song, N. Lee, J. H. Jung, Y. Cha, P. Leblanc, C. Neff, S. W. Kong, B. S. Carter, J. Schweitzer and K. S. Kim (2018). "Pluripotent stem cell-based therapy for Parkinson's disease: Current status and future prospects." Prog Neurobiol 168: 1-20.
Takahashi, K. and S. Yamanaka (2006). "Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors." Cell 126(4): 663-676.


Copyright(c) Korean Endocrine Society. All rights reserved.