



핵 호르몬 수용체에 의한 철 대사 조절 연구
김돈규(전남대학교 호르몬연구센터)
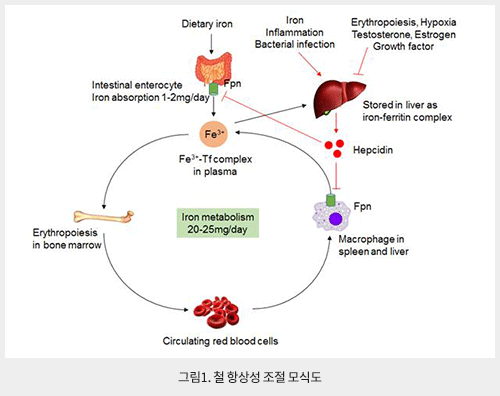
철(Fe)은 살아있는 거의 모든 생명체가 필요로 하는 필수 미량원소(trace element) 중에 하나로 고등동물에서는 헤모글로빈(hemoglobin), 시토크롬(cytochrome), 카탈라아제(catalase) 등 주로 생물학적 산화(oxidation) 또는 산소운반 등 수송(transport)에 관여한다. 우리 몸에서는 약 3-5g의 철을 가지고 있으며 그 중 대부분의 철(2-3g)은 적혈구의 헤모글로빈 및 근육의 미오글로빈(myoglobin)에서 헴(heme)과 결합된 형태의 철(Fe2+)로 존재한다. 그러므로 인체에서 새로운 적혈구 생성 및 세포 내 대사에 필요한 대부분의 철(20-25mg)은 대식세포가 노쇠한 적혈구를 탐식하여 철을 재순환(recycling) 함으로써 공급된다. 반면, 상처로 인한 출혈 (여성의 경우 생리) 및 혈액응고로 인해 체외로 빠져 나가는 소량의 철(1-2mg)은 음식물을 통해 다시 흡수한다. 그 외에 대부분의 철은 간(1g)에 저장한다. 인체 내에서는 체외로 철을 방출하는 경로는 존재하지 않기 때문에 철의 균형(iron balance)은 주로 십이지장에서 흡수하거나 대식세포의 철 재순환을 통해 유지된다 (그림1).
십이지장에서 철의 흡수는 장세포(enterocyte) 막에 존재하는 divalent metal transporter 1(DMT1)을 통해서 이루어지고, 흡수된 철은 세포 내에서 철 결합 단백질인 ferritin과 결합한 형태로 저장되거나 세포막에 존재하는 iron exporter인 ferroportin(Fpn)을 통해서 혈장으로 배출되어 transferrin(Tf)과 결합된 형태로 간 및 골수로 이동하게 된다. 한편 노쇠하거나 손상된 적혈구는 주로 비장, 간, 골수의 대식세포 식작용(phagocytosis)을 통해 분해되고, phagolysosomal membrane에 존재하는 iron exporter인 natural resistance-associated macrophage protein 1 (NRAMP1)에 의해서 배출된 후 ferritin과 결합하여 세포 내에 저장되거나 Fpn을 통해 세포 밖으로 빠져 나가 Tf과 결합한 후 재순환된다. Tf와 결합된 철(holo-Tf complex)은 각 조직으로 운반되고, 세포의 막에 존재하는 transferrin receptor 2(TfR2)을 통해 함입(internalization)되어 세포 내에서 DMT1 (대식세포에서는 Nramp1)을 통해 세포질로 배출된다. 그러나 체내 철의 양이 급격히 증가하는 경우, 철과 결합된 Tf는 포화(saturation) 상태가 되고, Tf에 결합되지 않은 철(non-transferrin iron, NTBI)이 증가하게 된다. 결국, 세포 내에서 NTBI는 활성산소종 (reactive oxygen species, ROS)를 유발하여 세포 손상을 초래한다.
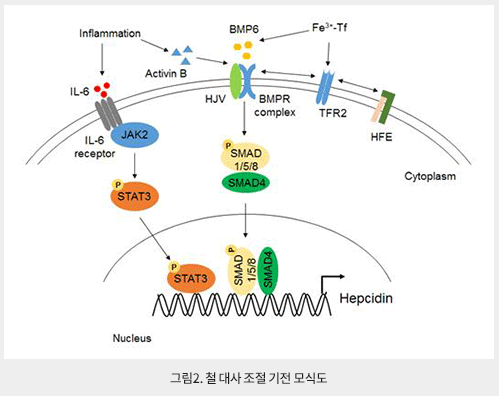
Hepcidin은 84개 아미노산 prepropeptide에서 만들어지는 25개 아미노산으로 구성된 펩티드 호르몬으로 주로 간에서 (대식세포 및 지방세포에서도 낮은 농도로 만들어짐) 분비되는 체내 철 항상성 조절에 핵심 호르몬이다. Hepcidin의 발현은 전사(transcription) 단계에서 조절 되며 hepatic iron, plasma iron, inflammation, endoplasmic reticulum stress에 의해서 증가되고, iron deficiency, erythropoiesis, hypoxia, testosterone, estrogen, growth factors에 의해서 감소되는 것으로 알려져 있다. Hepcidin의 기능은 세포막에 존재하는 철 배출 막 단백질인 Fpn과 결합 후 세포 내로 함입 및 분해하여 세포의 철 방출을 억제한다. 따라서 혈장에 존재하는 철(Fe3+-Tf)의 양이 증가하는 경우, 간세포의 bone morphogenetic proteins (BMPs)-mothers against decapentaplegic homologs (SMADs) 경로를 통해 hepcidin의 발현이 증가되어 Fpn이 분해된다. 그 결과, 십이지장에서 음식물을 통해 흡수된 철과 대식세포가 함유한 철, 그리고 간세포에 저장된 철이 혈장으로 유입되는 것이 차단되어 철 농도가 감소한다. 반대로 혈장의 철 농도가 감소하는 경우, BMPs-SMADs 경로가 억제되어 hepcidin이 감소하고, 장세포, 대식세포 및 간세포 내의 철이 Fpn을 통해 방출되어 혈장의 철 농도가 증가하게 된다. 결국, 세포대사 및 적혈구생성 (erythropoiesis)에 필요한 양의 철을 철 과다로 인한 세포 독성 없이 제공하기 위해서는 철과 hepcidin 사이에 되먹임 고리 (feedback loop)를 통해 철 항상성이 엄격하게 유지되어야 한다. 그러므로 hepcidin은 체내 철의 양을 조절하는 전신성 철 항상성 (systemic iron homeostasis)의 주요 조절자의 기능을 한다 (그림2).
이러한 hepcidin의 기능이 비정상적으로 조절되는 경우 철 결핍(iron deficiency) 및 철 과다(iron overload)를 유발하여 질병을 야기하게 된다. 예를 들면, hepcidin (HAMP) mutation 또는 BMP6, HFE2, SMAD4, TFR2, HFE mutation은 hepcidin 발현이 감소되고, 그 결과 장세포와 대식세포 막의 Fpn을 통해 음식물을 통한 철 흡수와 대식세포의 철 방출을 촉진시켜 혈장의 철 농도가 증가하게 된다. 이러한 철 농도의 증가는 혈장의 Tf를 포화시키고, 세포 독성을 유발하는 NTBI의 농도를 증가시켜 간세포 및 다른 조직에 축적된다. 흥미롭게도 hepcidin의 발현이 낮을 경우, 간세포에서는 Fpn의 다량 발현됨에도 불구하고 철은 간세포에 축적된다. 그 이유는 과다한 철의 유입으로 혈장의 포화된 Tf (Fe3+-Tf)가 증가되고 이로 인해 증가된 NTBI가 간세포로 다량 유입되어 Fpn의 철 방출 능력을 감소시키기 때문이다. 반면, 감염, 자가면역질환, 암 등에 의해서 발생되는 proinflammatory cytokine (interferon-g, IL-1, IL-6)들 및 TMPRSS6 mutation은 hepcidin의 발현을 증가시킨다. 특히 IL-6의 경우, 간세포 내 Janus kinase 2 (JAK2)-signal transducer and activator of transcription 3 (STAT3) 경로를 활성화시켜 hepcidin의 발현이 증가된다. 그 결과, Fpn이 분해되어 장세포에서 철의 흡수가 억제되고, 간세포 및 대식세포의 철 방출이 차단되어 저철혈증(hypoferremia) 및 대식세포 내에 철이 축적되게 된다. 흥미롭게도 말라리아 (Malaria) 및 비브리오균 (Vibrio vulnificus) 감염의 경우, 염증반응으로 인한 철 대사의 변화는 말라리아가 숙주의 철을 이용하여 증식 할 수 없도록 함으로써 감염을 억제하는 숙주의 방어기전으로 사용될 수 있다는 것이다. 그러나 이런 숙주의 내재면역 반응 (innate immune response)은 만성 염증성 질환의 경우 철 부족으로 인해 적혈구생성에 필요한 철이 부족하여 만성 질환성 빈혈(anemia of chronic disease)을 야기한다. 결국 경우에 따라서 염증반응으로 인한 철 대사의 변화는 숙주에게 양날의 검으로 작용할 수 있다.
핵 호르몬 수용체는 리간드 결합 부위 (ligand-binding domain)를 가지고 있어서 저분자 물질 및 호르몬을 인지하는 세포 내 센서로서 세포 내 표적유전자의 발현을 전사과정에서 조절한다. 핵 호르몬 수용체는 인간에서 48개가 발굴되었고, 생체 내 리간드가 밝혀진 핵 호르몬 수용체와 아직 리간드가 알려지지 않은 고아핵수용체로 구분된다. 현재까지 많은 연구자들이 생체 내 핵 호르몬 수용체들의 유전자발현 및 표적유전자 조절에 관한 많은 정보들을 제공하였고, 이를 이용하여 신경계, 내분비계, 생식계, 면역계 등 다양한 질환의 신약 표적단백질로 활용하고 있다. 지금까지 철 대사 조절에 있어서 핵 호르몬 수용체의 기능이 밝혀지지 않아 핵 호르몬 수용체에 의한 철 대사 조절 기전을 규명하고, 리간드 특이적으로 조절되는 핵 호르몬 수용체의 특성을 활용할 경우 비정상적인 철 대사 조절로 발생하는 다양한 인체질환 치료제 개발의 원천 기술 확보가 가능하다.
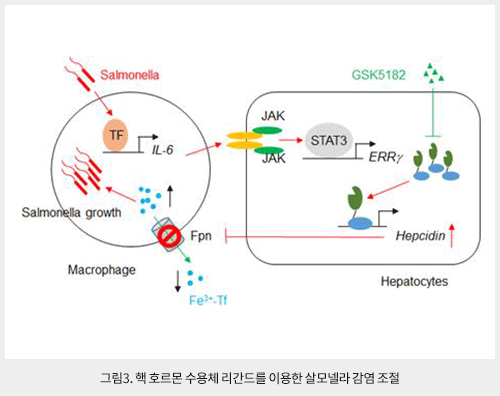
최근 본 연구진은 고아핵수용체 estrogen-related receptor gamma (ERRγ)가 철 대사 조절 호르몬인 hepcidin의 발현을 조절하는 새로운 분자기전을 규명하였다 (그림3). 살모넬라 (Salmonella typhimurium)가 감염될 경우 proinflammatory cytokine인 IL-6가 증가되어 JAK2-STAT3 경로를 활성화시키고, ERRγ의 발현을 증가시킨다. 증가된 ERRγ는 hepcidin의 발현을 증가시켜 저철혈증을 유발하는 동시에 대식세포 내 철이 축적된다. 살모넬라는 세포 내에서 증식하는 세균으로 대식세포에 축적된 철을 활용하여 더욱더 증식하게 된다. 따라서 ERRγ의 활성을 억제하는 리간드를 이용하여 hepcidin의 발현을 억제할 경우 대식세포 내에 존재하는 철을 감소시켜 세포 내 살모넬라 증식을 억제할 수 있음을 규명하였다 . 특히 ERRγ 리간드는 숙주의 철 대사 조절을 통해 살모넬라 감염을 억제하기 때문에 항생제 내성을 지닌 살모넬라 증식 억제에도 상당한 효과를 나타냈다. 향후 이러한 발견은 항생제 내성을 가진 슈퍼박테리아 감염을 억제하는 항균제제 개발에 원천 기술이 될 수 있음을 시사한다. 한편, 최근까지 철 대사 조절과 관련된 co-repressor에 대한 연구는 거의 이루어지지 않았다. 본 연구진은 고아핵수용체 small heterodimer partner (SHP)가 철 항상성 조절에 핵심 조절 기전인 BMP6-SMADs 경로를 억제하는 새로운 분자기전을 규명하였다. 혈액 내 철 농도가 증가할 경우, BMP6-SMAD1/5/8이 활성화되어 hepcidin의 발현이 증가하게 되는데 SHP는SMAD1이 hepcidin promoter에 결합하는 것을 억제하여 hepcidin의 발현이 억제되는 것을 규명하였다. 특히 SHP의 발현을 증가시키는 AMP-activated protein kinase (AMPK) 활성 물질을 이용하여 비정상적인 철 대사 제어에 기여 할 수 있음을 밝힌바 있다.
앞서 언급한 바와 같이 철은 생체 내에서 합성되지 않아 반드시 음식물을 통해서만 흡수가 가능하여 철 항상성 조절이 잘 유지되지 않을 경우 이와 관련된 다양한 인체질환을 야기하게 된다. 따라서 철 대사 조절 및 항상성 유지에 중요한 핵심 단백질 및 이들 단백질들의 발현을 조절하는 핵 호르몬 수용체 발굴을 통해 철 대사 조절 분자기전을 규명하는 연구는 향후 철 대사 질환 및 병원균 감염을 제어할 수 있는 새로운 패러다임의 원천 기술을 제공 할 수 있다. 특히 핵 호르몬 수용체는 그 리간드에 의해서 특이적으로 조절되므로 핵 호르몬 수용체에 의한 철 대사 조절 연구를 통해 철 대사 질환 치료제 개발의 핵심 단초를 제공할 수 있다. 본 연구실은 주로 핵 호르몬 수용체에 의한 철 대사 조절 기전 규명 및 철 대사 질환을 치료할 수 있는 원천기술 개발을 위한 다양한 연구를 진행하고 있다. 철 대사 조절과 관련된 핵심 단백질들을 발굴하고 이들을 조절할 수 있는 새로운 핵 호르몬 수용체 및 전사조절인자들을 찾기 위해 연구를 진행하고 있다. 특히 최근에는 hepcidin의 발현이 생체시계(circadian rhythm)에 의해 조절되어 생체 내 철 대사의 변화를 야기하는 결과를 확인한 바 있다. 추가로 hepcidin 발현을 조절하는 핵심 경로인 BMP6-SMADs 및 IL-6-STAT3 활성화 경로를 조절하는 새로운 co-repressor를 발굴하여 현재 추가 연구를 진행하고 있다.
Delphine Meynard et al. The liver: conductor of systemic iron balance. Blood. 123, 168-176 (2014)
Escobar-Morreale HF. Iron metabolism and the polycystic ovary syndrome. Trends Endocrinol Metab. 23, 509-515 (2012)
Kim DK et al. Inverse agonist of estrogen-related receptor controls Salmonella typhimurium infection by modulating host iron homeostasis. Nat Med. 20, 419-424 (2014)
Kim DK et al. Orphan nuclear receptor SHP regulates iron metabolism through inhibition of BMP6-mediated hepcidin expression. Sci Rep. 6, 34630 (2016)


Copyright(c) Korean Endocrine Society. All rights reserved.