



비알코올성지방간질환의 병리기전 및
유효인자 발굴 연구
노윤석(충북대학교 약학대학)
비알코올성 지방간질환(Nonalcoholic Fatty Liver Disease, NAFLD)은 음주와 관계없이 비만, 당뇨병, 고지혈증, 약물 등의 원인에 의하여 발병될 수 있으며, 진행경과에 따라 간세포에 지방의 과도한 축적만 존재하는 단순 지방간(Simple Steatosis, SS), 간세포 괴사와 염증과 섬유화를 동반하는 비알코올성 지방간염(Nonalcoholic Steatohepatitis, NASH) 및 더 진행된 형태인 비알코올성 지방간섬유증 (Nonalcoholic Steatofibrosis, NASF) 및 간경변증 (Cirrhosis) 을 포함하는 일련의 질환군을 의미한다. 고지방 및 고열량 식이섭취(Fast Food, Instant Food)의 증가에 따른 성인병의 증가로 인해 NAFLD 유병률은 서구의 여러 국가뿐만 아니라 한국에서도 최근 증가하고 있으며, 국가마다 차이가 있지만 선진 국가에서 전체 인구의 약 20~30%로 보고하고 있다.
렙틴을 통한 체중 조절 항상성 기전이 존재함에도 현재 비만이 급증하는 이유는 과영양과 운동부족이 렙틴 저항성을 유도하기 때문이다(그림 1). 비만인 사람이나 동물모델에서 혈액 속 렙틴의 양은 비만이 아닌 경우보다 오히려 많은데, 렙틴이 뇌 속으로의 전달에 문제가 있거나 시상하부의 렙틴 수용체를 통한 신호전달계 활성화 저해 등을 렙틴 저항성 및 비만의 원인으로 보고있다. 항비만치료제로 GLP-1 receptor agonist, lorcaserin, phentermine, orlistat 등이 이용되고 있으나, 렙틴 저항성이 비만의 주된 원인에도 렙틴 저항성 극복을 통한 비만치료제는 나와있지 않다. 최근 진행되고 있는 연구들은 비만 및 렙틴 저항성이 시상하부 내 세포들의 세포내 스트레스(Intracellular stress), 특히 소포체 스트레스(endoplasmic reticulum stress, ER stress)에 의해 유도되고, 소포체 스트레스를 경감시키면 렙틴 저항성 극복과 함께 비만이 완화됨을 보임으로써, 소포체 스트레스 관련 신호전달계들이 비만과 같은 대사질환 치료에 이용될 수 있음을 시사하고 있다.
높은 유병률의 NAFLD 환자의 다수는 임상적인 의의를 가지지 않는 단순 지방간(SS)으로 임상 경과가 양호하다. 하지만 임상적 심각성은 NAFLD 환자 중 약 10~20%에서 NASH가 발생하고 이 NASH 환자 중 약 9~25%에서 간경변증으로 진행된다는 사실이다. 일부 통계에 의하면 미국 성인의 12%가 NASH에 이환된 것으로 보고되었다. 따라서 단순 지방간(SS)에서 지방간염(NASH) 및 지방간섬유증 (NASF) 으로 전환되는 과정을 차단하는 것이 지방간염 치료제 개발의 핵심이다. 현재까지 NASH 환자에게 사용되고 있는 치료제는 인슐린 저항 치료제 (pioglitazone)등과 같이 위험인자의 교정을 통해 NASH을 개선하는 약제 및 vitamin E 등 항산화제가 권고되고 있다. 그러나 이러한 약제들은 장기간 사용에 대한 안정성 문제 및 본질적인 치료제가 아닌 증상 개선제로 이용되는 한계로 인하여 표적 치료의 효과로 볼 수 없다. NAFLD의 유병률을 감안할 때 NAFLD 치료제 시장은 2025년까지 30~40조원에 달할 것으로 추정되며, 최근에 많은 제약회사 및 대학, 연구소에 의해 치료제 개발을 위해 노력하고 있지만, 현재까지 미국 FDA의 인증을 받은 치료제는 시판되지 않고 있어 NAFLD 연구의 중요성은 크다.
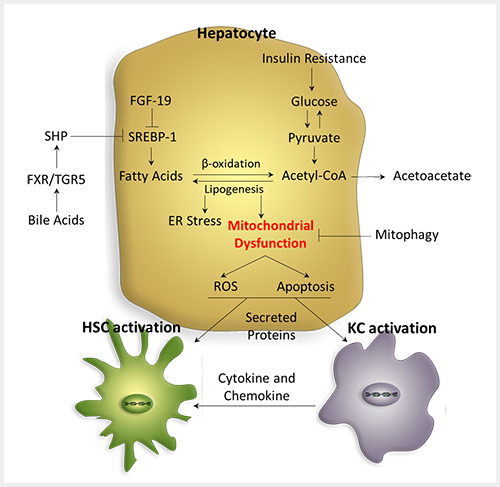
동물 및 사람에서의 많은 연구에 따르면, NAFLD에서 산화적 스트레스는 과도한 유리지방산에 의해 발생하며 지방산의 산화는 정상적인 상태에서는 주로 미토콘드리아의 β-oxidation에 의해 이루어져 에너지 생산을 하게 되지만, NAFLD에서 지방산의 유입이 과다해지면 미토콘드리아의 β-oxidation이 포화가 되고 퍼옥시좀(peroxisome) 및 마이크로좀(microsome)과 같은 다른 세포소기관에서의 산화 과정이 증가하면서 활성산소종(Reactive Oxygen Species, ROS) 생성이 증가된다 [그림 1]. 한편 미토콘드리아에서도 과도한 유리지방산 유입으로 β-oxidation이 증가함에 따라 산화과정에서 발생하는 전자(electron)가 과도하게 발생하고 미토콘드리아 호흡사슬(respiratory chain)에 원활하게 전달되지 못하면 미토콘드리아에서 ROS 생성이 더욱 증가하여 미토콘드리아DNA(mtDNA)를 손상시켜 미토콘드리아의 기능장애를 야기한다. 실제로 NASH 환자에서 현미경적으로 미토콘드리아의 종창(swelling), mitochondrial cristae의 소실, paracrystalline inclusions가 관찰되는 일련의 변화를 볼 수 있고, 미토콘드리아 호흡사슬의 활성도가 감소되는 것을 관찰 할 수 있다. 뿐만 아니라 최근의 몇몇 연구에서 미토콘드리아의 기능성이 NASH의 발생에 강한 연관성을 가진 것으로 보고되고 있다. 따라서 NAFLD 병리기전에서 미토콘드리아의 기능성 유지(Mitochondria Quality Control)에 대한 많은 연구가 요구된다. 미토콘드리아의 기능성 유지를 조절하는 기전은 대표적으로 미토콘드리아의 유비퀴틴화 (Mitochondrial Ubiquitination) 작용이다. 현재까지 여러 종류의 유비퀴틴 사슬이 발견되었고 각 사슬마다 서로 다른 기능을 가지며 대표적으로 K48-유비퀴틴 사슬과 K63-유비퀴틴 사슬이 미토콘드리아의 기능성 유지에 중요한 것으로 추측되어 왔다. 실제로 손상을 받은 미토콘드리아는 K48-유비퀴틴화 될 수 있으며 이후에 프로테오좀(Proteosome)에 의해 선택적으로 분해된다. 한편, 자가포식작용 주요 분자인 SQSTM1이 K63-유비퀴틴 사슬과 강한 결합성을 가지기 때문에, K63-유비퀴틴 사슬은 주로 Mitophagy 기전과 큰 관련성이 있을 것으로 주목받고 있다. 그림 1에서와 같이 간세포 유래 ROS 및 사멸된 간세포 자체는 주변의 쿠퍼세포 및 간성상세포의 활성화를 유발한다. 따라서 간세포 내의 스트레스 및 2차적인 비실질세포 (쿠퍼세포 및 간성상세포)의 활성화를 억제하고자 하는 연구 및 치료제개발이 진행되고 있다.
현재까지 수많은 연구들 통해 염증세포에서 분비되는 여러 가지 싸이토카인 및 케모카인, 성장인자에 대한 연구는 활발히 이루어져 왔다. 앞서 설명한 NAFLD의 병리기전에서와 같이, 기전의 시작은 간세포의 지방축적이다. 따라서 미토파지 및 간세포내 지방대사 기능부전에 의해 지방이 과도하게 축적된 간세포의 특성 변화 연구에 집중해야 할 필요성이 있다. 최근에 지방이 축적된 간세포(Lipid-laden hepatocyte)에서 분비된 C18:0이 간 내 특정 림프구의 면역활성을 조절하고 간암의 발생에 영향을 주는 것으로 보고되었으며 기존의 여러 연구에서 간세포에 의해 분비되는 케모카인 및 성장인자들이 보고되었다. 즉, 간의 병리기전에서 간세포의 분비능에 대한 재조명이 필요하고 분비물질에 대한 정확한 분석(Secretome)이 요구된다. 앞서 설명한 바와 같이, 단순지방간에서 더욱 발전된 병리단계인 NASH와 NASF가 임상적으로 중요성을 갖기 때문에, 최근 NAFLD 치료제 개발과정에서 가장 주목을 받고 있는 표적 세포군이 바로 쿠퍼세포와 간성상세포이다. 즉, 간내 염증반응의 많은 부분이 쿠퍼세포에 의해 매개하며, 활성화된 쿠퍼세포는 다양한 싸이토카인 및 케모카인 분비를 통해 추가적으로 간성상세포의 활성화 및 간세포의 사멸을 유도하여 NASH를 악화시킨다. 한편 간성상세포의 활성화는 다양한 세포외기질의 생산을 유발하여 간의 섬유화 및 간경화를 매개하는 세포군이다. 따라서 NAFLD 병리기전 연구에서는 간 내 세포군 특이적인 반응 및 작용을 관찰하고 규명할 필요성이 크다.
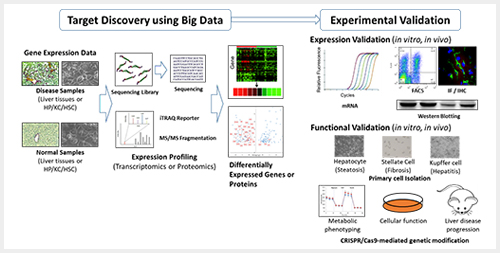
본 연구실에서는 NAFLD의 병리기전 규명 및 표적인자 발굴을 위한 연구를 그림 2와 같이 진행하고 있다. 다양한 빅 데이터를 통해서 확보된 표적인자의 기능 검증을 위해서 in vitro 및 in vivo 실험을 통한 검증과정을 거치게 된다. 또한 CRISPR/Cas9 시스템을 활용한 표적인자의 유전자변형을 통한 in vitro 및 in vivo 실험을 통한 표적인자의 작용을 규명하게 된다. 이 과정에서 앞서 설명한 3가지 세포군 각각의 고유 작용 연구 및 표적세포군 발굴 또한 효과적인 표적치료제 개발에 중요한 과정이 될 수 있다. 이러한 연구가 NAFLD 병리기전 규명 및 치료제 개발에 기여할 것으로 기대된다.
1. Hepatology 2014 Jul;60(1):237-49.
2. J Clin Invest. 2014 Aug;124(8):3566-78.
3. Gastroenterology. 2015 Jan;148(1):252-254.
4. Am J Pathol. 2018 Apr;188(4):967-980.
5. Am J Pathol. 2018 Epub ahead of print


Copyright(c) Korean Endocrine Society. All rights reserved.